· 名前は、化学式を後から読んだ形になっている。 うしろから、2個の酸素と炭素で二酸化炭素、後ろから2、O、CでCO2という規則性がある。 このことを知っていれば、塩化ナトリウムもナトリウムが前で塩素が後、NaClと見当がつく。 · イオン式の一覧を中学生向けに作成 しました。 さっそくイオン式の一覧を下に載せますが、 その下にはさらに、 化学式やイオン式の確認と解説 や イオン式の練習問題 も作ったので、ぜひ勉強に活用してください! 陽イオン 赤字がよく出るもの 水素ヘリウム Helium CAS No UN No 1046 GHS分類 シンボルマークの表記について 可燃性/引火性ガス 支燃性/酸化性ガス 高圧ガス :区分外 :区分外 :圧縮ガス 化学式 He 蒸気圧 1013(26℃) kPa 分子量 400 引火点 なし(不燃性) ℃ 外観 無色・無臭の気体 発火点
なぜ原子番号が1つ違うだけで 水素とヘリウムのように全く違う性質になるのですか Quora
ヘリウム 化学式としての意味
ヘリウム 化学式としての意味-ヘリウムhelium 周期表元素記号=He 原子番号=2原子量=±2安定核種存在比 3 He=13×10 -4 %, 4 He=約100%融点=-2722℃ (26気圧) 沸点=-26℃気体の密度=g/ l (0℃,1気圧)液体の比重=0147 (-2708℃)臨界温度=-℃ 臨界圧=224気圧水に対する溶解度=097m l /100m l (0℃)電子配置=1s 2 おもな酸化数=0周期表0族に属する希ガ造式に類似しているところから,Paulingにより共鳴構造式と呼ばれ,有 機化学に共鳴理論が多く取り入れられるようになった.しかし,VB は,結合軸回りの角運動量が1であることを意味 図14・24Heの1sオービタルの重なりから作られたヘリウム



化学的に安定なヘリウム He に化合物は存在するのか
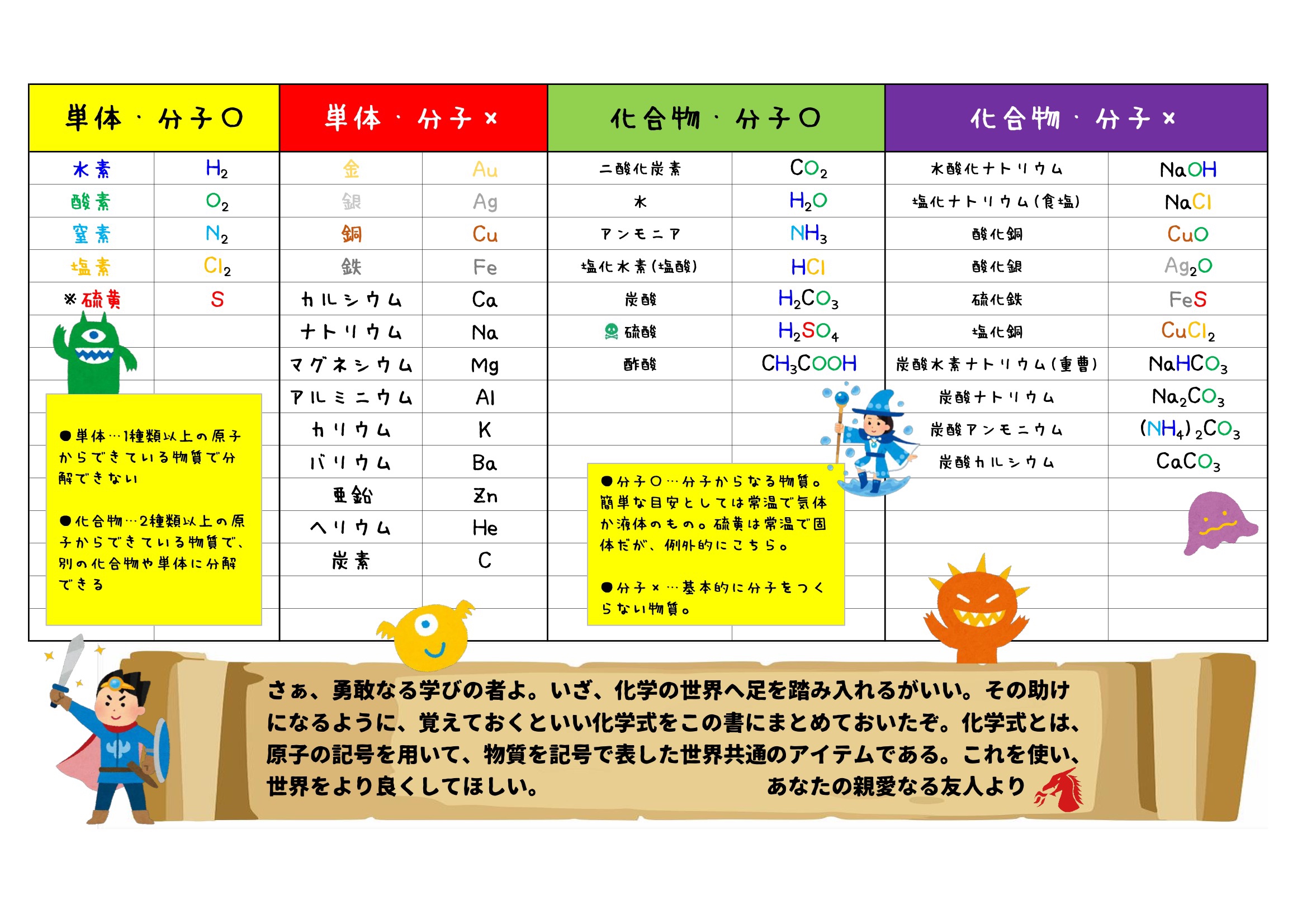
周期表 18族に属するヘリウム,ネオン,アルゴン,クリプトン,キセノン,ラドンの6元素の総称。 ヘリウムは2個,そのほかは8個の価電子をもつ安定な電子配置のため,化学的には非常に不活性で,化合物をつくりにくいが,励起状態では酸化物,フッ化物や塩化物などの化合物をつくるものがある。 単体 は 単原子気体 で,分子間力が小さいため,いずれも沸点が質問:「説明」の化学 ――「説明」の化学―― 前に戻る Q7 「残留塩素」と「塩素イオン」の違い. Q1 ヘリウムの性質について. Q0 SO 2 の実験的製法と希硫酸の反応性について. Q199 酢酸溶液中における酸の水平効果について. Q197 イオン化傾向を化学式 物質を元素記号を用いて表したものを 化学式 という。 分子を作る物質では化学式が1つの分子を表している。 例 o o 酸素分子 酸素分子は酸素原子2つで できているので o 2 と表す。 h h o 水分子 水分子は水素原子2つと酸素原子1つで できているので h
· Heの元素記号としての意味はヘリウムですよね。 では、化学式としての意味は何ですか? 化学式としての意味は、「単原子分子である」という事かな。 · ある意味、それは反ヘリウムガスのようなものです。ヘリウムは空気の約6倍軽いのに対し、六フッ化硫黄は6倍重いからです。 六フッ化硫黄の事実 化学式sf · ψ=c 1 φ 1 c 2 φ 2 となります。 ψは2つの水素原子の間を動き回る電子の状態(波動関数)を表します。 c 1 とc 2 はφ 1 とφ 2 の割合を表す係数
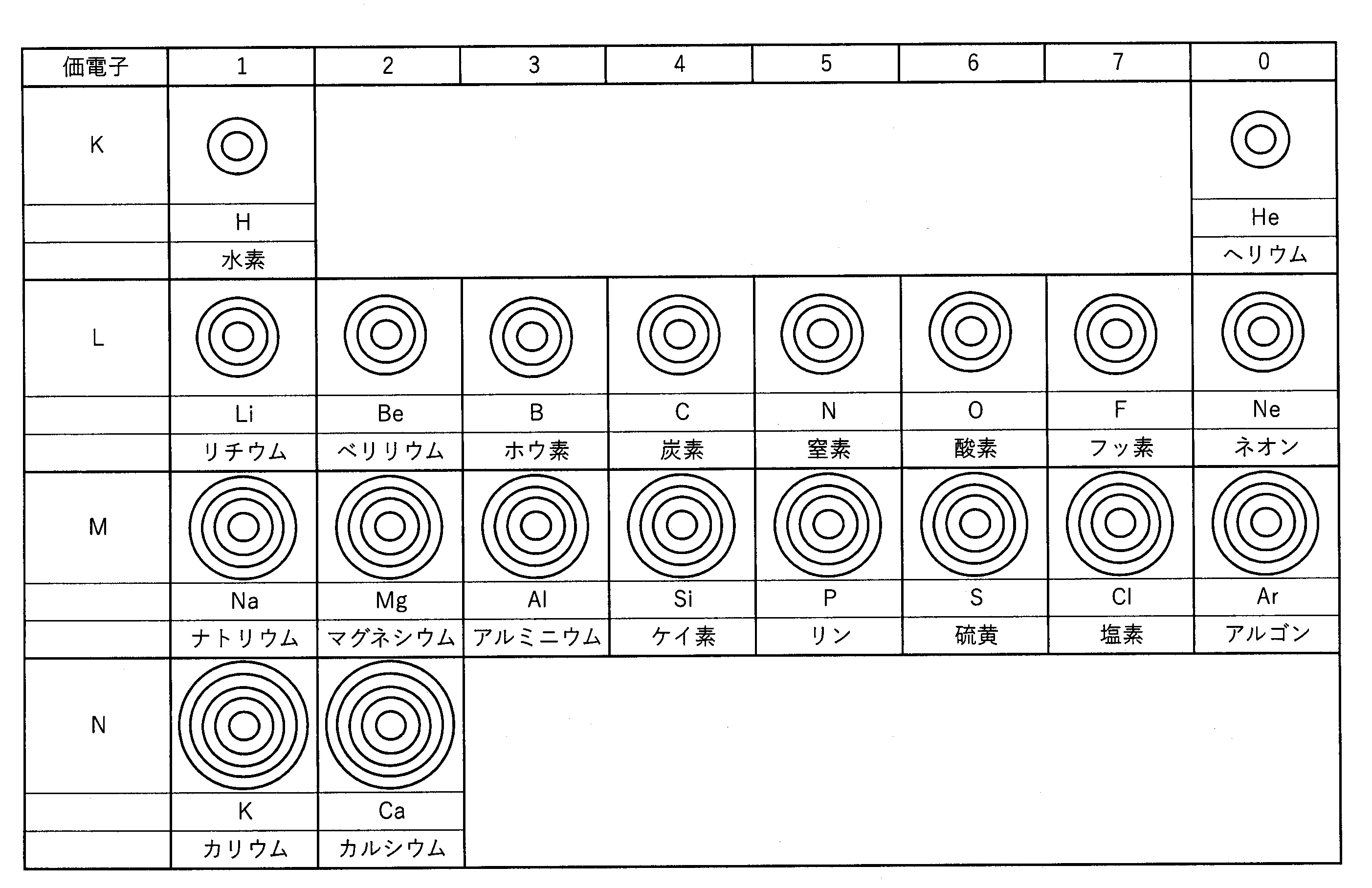
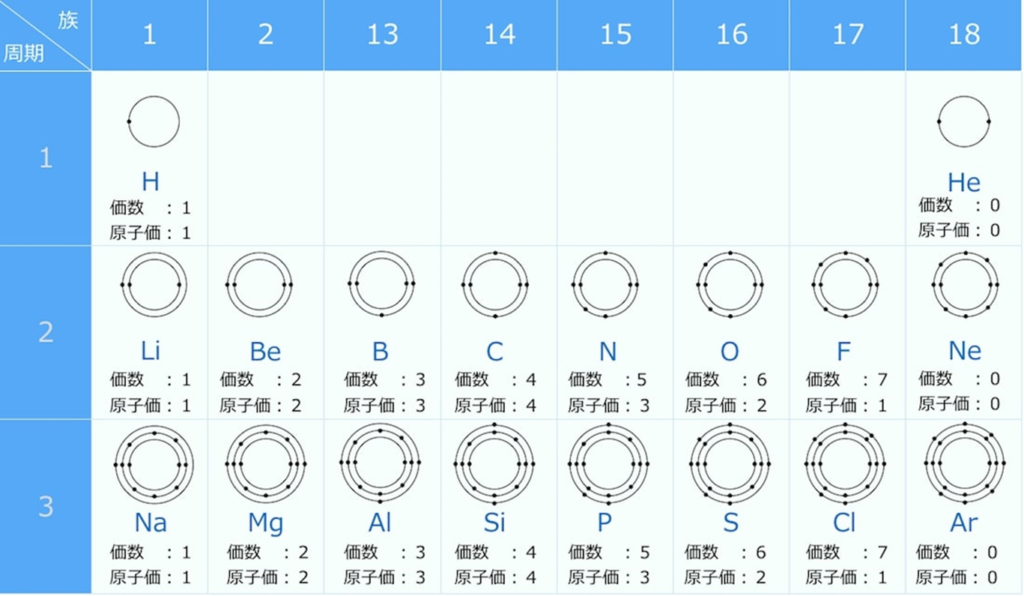
希ガス原子の 最外殻に入っている電子の数はヘリウムHeが2個、他の元素はすべて8個で安定 しており、他の族に属する元素に比べて 化合物を作りにくい のが最大の特徴です。 このために、 希ガスは安定している と表現されることがあります。 希ガスの場合、価電子は「0」という 他の族と同じように単体の融点や沸点は、原子量の増加とともに高くなります · LHe 液体ヘリウム GHe ヘリウムガスであっていますか?「そういう書き方をするようにした」という決まりごとの下では「合っています」。世界中どこでもそれで通じるかというと、多分化学式の書き方は国際的なルールで決められています。 (例:塩化ナトリウムNaCl,酸化銅CuO)。 非金属だけでできている元素については,元素の並び順が決まっています。 ただし,「水酸化 」は OHとなり,このルールからは外れます。 化学式の書き方
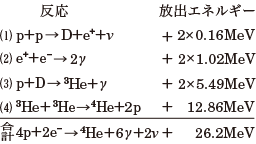



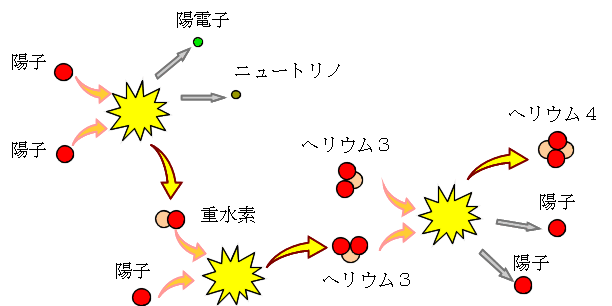
核融合とは コトバンク
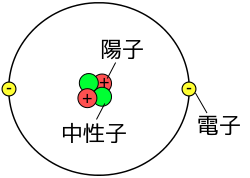



中学校理科 第1分野 化学変化とイオン Wikibooks
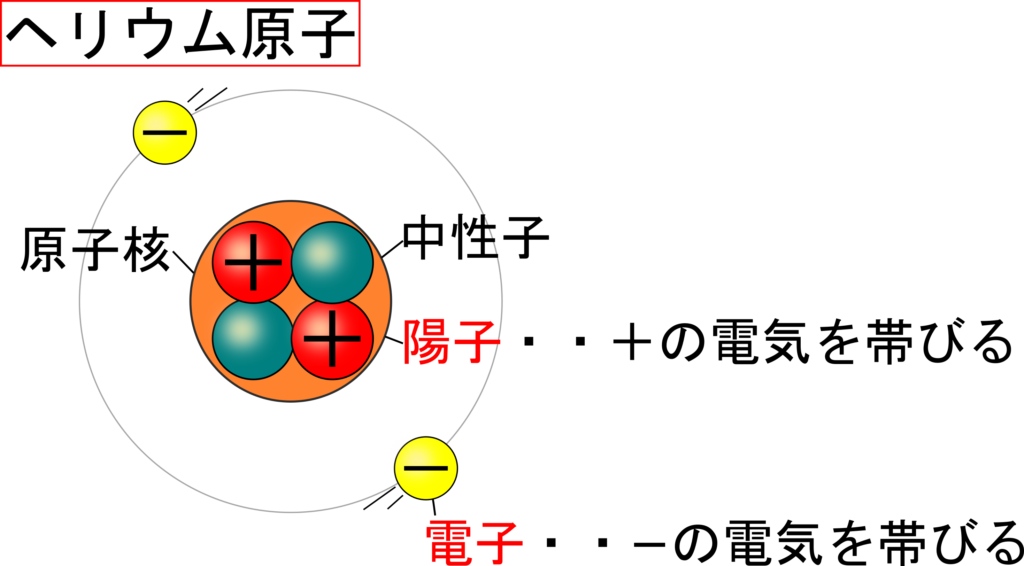
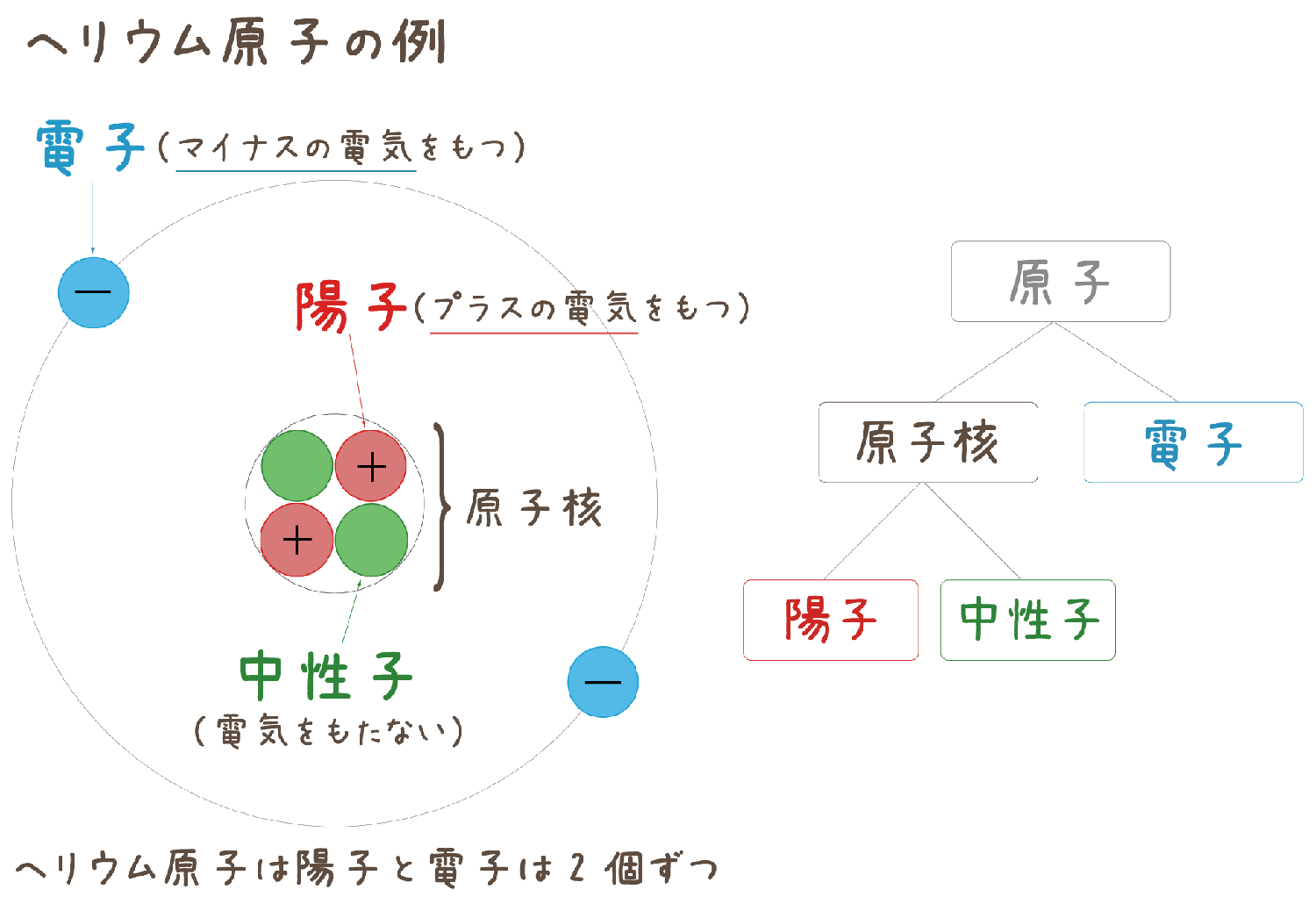
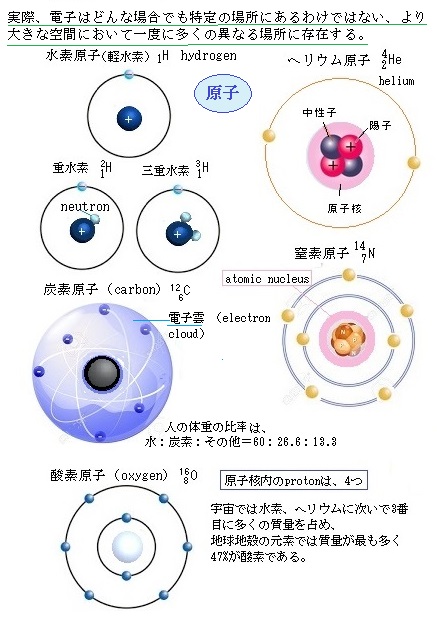
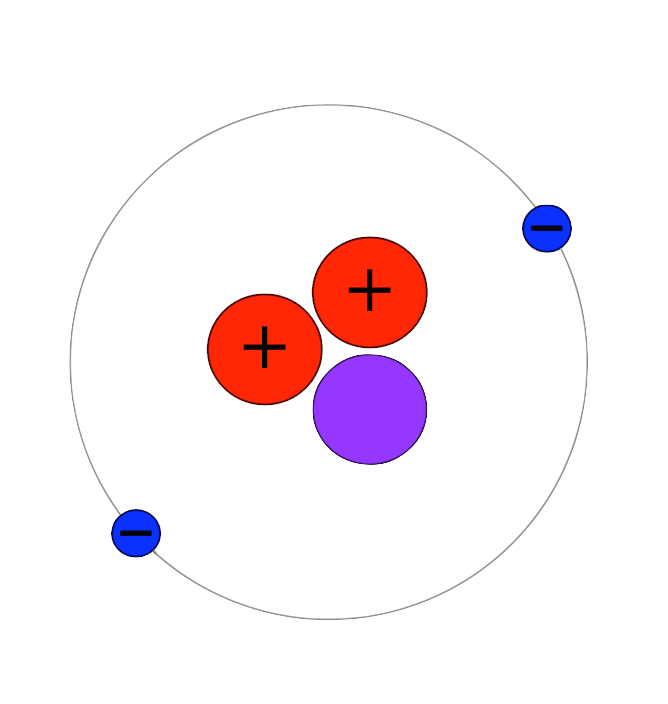
ヘリウム様の原子は 2つの負の電子 (1、 2) と 1つの正の原子核 (= Ze) を持つ。 (中性のヘリウム原子では この Z は "2" である。 Eq1 の最初の2つの項は 電子1と電子2の運動エネルギーを表していヘリウムの性質, 完全不活性(化学的安定・不燃性), 溶解度小, 極低温沸点, 高熱伝導率, 密度小, 拡散性良好, 無しげき性, 粘性小,超音速, 加圧・パージ用, 溶接用,雰囲気・シールド用, 冷却用, 浮揚用, リークテスト用, ガスクロ用, 医療用, 潜水用, 熱伝導用, 極低温生成用, 粉体製造用回答 二宮 5年弱前 水素はHの粒が1つあって成り立ってるのではなく、Hの粒が2つ(=H2)で成り立ってるからで、 例えば粒2つで成り立ってる水素が2つあれば2H2と表記します 対してAuやFeなどの金属を考えると粒1つでも銅やマグネシウムとして存在する、といえますよね だから、化学式ではFe2ではなく Feなどと表記します 粒1つで成り立ってる鉄が2つあれば2Feと




この オ について 解いてるときこれ 閉殻でもオクテットでもないよなって思って解説み Clear




高校化学基礎 元素の覚え方 映像授業のtry It トライイット
化学反応式の最初の学習であるため,誤りが多い事例については,クラス全体でも取り上げ,その問題 点を生徒に伝えておくようにしましょう。 生 徒の つ ま づ きポ イ ン ト カリウム 水素 ヘリウム 酸素 マグネシウム ウラン キュリウム 炭素 硫黄 · ヘリウムの化学式 組成式 分子式 構造式 分子量は 電子配置はH 2S 2O 4:亜ジチオン酸• Na SO 4 2:硫酸ナトリウムアルミニウムAl• ヘリウムの化学式・組成式・分子式・構造式・原子量(分子量)は?電子配置は? 科学的な解析を行う際には、まずその化学物質の基礎的な性質を理解しておく方がいいといえます。



なぜ原子番号が1つ違うだけで 水素とヘリウムのように全く違う性質になるのですか Quora



太陽
ヘリウムhelium 希ガス元素 の一。 無色・無臭 の、 水素 に 次いで 軽い 気体 。 沸点 は低く、 セ氏 マイナス26度。 化学的 には 不活性 で、他の 元素 と 化合物 をつくらない。 宇宙 での 存在 は 水素 に 次いで 多く 、 大気 中に わずかに 含まれる 。 気球 用 ガス ・ 極低温 用 寒剤 などに 利用 。 太陽 紅炎 の スペクトル線 から 発見 され、名は 太陽 の硫化水素 H2s の化学式 分子式 構造式 電子式 分子量は 硫化水素の代表的な反応式は · image by StudyZ編集部 ヘリウムはα崩壊によって生成することが有名です。 高校化学でも出てくるので、しっかり覚えておきましょう。 α崩壊とは、原子がヘリウムの原子核を放出して他の原子に変化することです。 ヘリウムの原子核は陽子と中性子2つずつからなるので、原子番号は2、質量数は4だけ減少することになりますね。 地球上にとどまれないヘリウムが



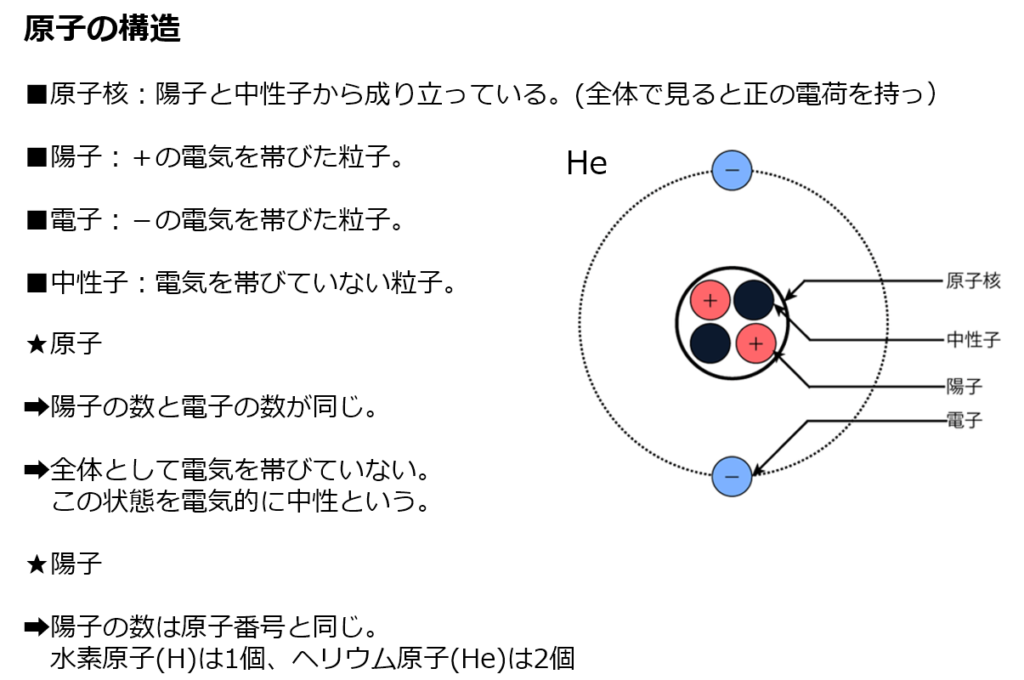
中学3年 原子の構造を理解すればイオンが完璧に理解できる 原子とイオンの関係とは 理科の授業をふりかえる



中3理科の学習ポイント 今すぐニガテを克服しよう 家庭教師ジャニアス
· 食塩水は塩化ナトリウムと水の混合物なのでNaClとH2Oです。 雪女 2年弱前 分かりました! ありがとうございます! この回答にコメントする mocha 2年弱前 食塩、塩化ナトリウムはNaCIですが 食塩水は水溶液なので化学式はないと思います!ヘリウム原子 (基礎物理化学A、補助資料) 摂動法 ヘリウム原子の電子状態を、水素類似1s 原子軌道の積で近似する。 0(r1;r2) = '1s(r1)'1s(r2) (1) '1s(r) = 1 p ˇ Z a0 3 2 e Zr=a0 (2) このとき、1次の摂動エネルギーは h 00jHj 0i = 1 ˇ2 Z a0 6 Z Z e2 r12 e 2Z(r1r2)=a0dr 1dr2 (3 · 水素分子は2個の水素原子からできていて、H 2 と表されることは皆さんもご存知のことと思います。 では、なぜ水素原子は2個集まるとH 2 になり




化学的に安定なヘリウム He に化合物は存在するのか



これの解答お願いします 化学式 物質のつくりを原子の記号と数字 Yahoo 知恵袋
· 解決済み @270ekyi0e 21/3/25 2156 酢酸の化学式はCH3COOHで、酢酸イオンのイオン式はCH3COOになる意味が分からないですHはどこにいるんですか? またCH₃CO₂Hと書かないで、わざわざCH₃COOHとなるんですか? 頭のいい人教えてください! 中学生 理科 高校生 · 化学式水素はH2 ヘリウムはHe なのは何故ですか? ヘリウムも同じ気体で単体なのだからHe2 とはならないのは何故ですか? また、同じようにネオンやアルゴンもNe2やAr2と表さないのは何故ですか?また、Δ r G° の単位には、反応進行度 ξ の 1 mol あたりという意味で mol1 が付きます。 (参照 圧平衡定数の式の次元が合わない ) 各物質の 25 °C, 1 bar における物性値( マッカーリ・サイモン より)




ヘリウム 化学式



Q Tbn And9gcsb1nq Vcg6essbd6hm 0rhdfgsfo930olphhmm3p0 Usqp Cau
2 基本的な化学反応式 学習の始めの時期に書けるようにするべき反応式の例 1.水素と酸素が化合すると,水になる。 2h2+o2→2h2o 2.水を電気分解すると,水素と酸素を発生する。 2h2o→2h2+o2モルと化学反応式 0 なぜモルについて理解しなければならないのか 1 molという物質量が,602×1023個という数を意味 ヘリウムのモル質量は40 g mol1なので,1 molのヘリウム · ヘリウムの相対質量の求め方 浪人の夏休みまで死ぬほど勉強したにも関わらず偏差値50を割ることも。 そんな状態から効率よく化学を学び化学の偏差値を68まで爆発的に伸ばした。 その経験を塾講師としてリアル塾で発揮するも、携われる生徒の数に限界




ヘリウム Wikipedia




教科書を書き換えるか ヘリウムの化合物 Chem Station ケムステ




アルゴン Ar 産業ガス 産業ガス関連事業 事業 製品 エア ウォーター株式会社




原子価とは 原子価の求め方までわかりやすく解説 高校生向け受験応援メディア 受験のミカタ




ヘリウム 化学式 ヘリウムってどんな物質 身近な例とともに化学系学生ライターがわかりやすく解説



Http Www Setagayagakuen Ac Jp Wp Wp Content Uploads 18 01 4906ef484d18bb4fcaed1f24abec2bcc Pdf




ヘリウム 化学式 職場のあんぜんサイト 化学物質 ヘリウム




原子分子物理 原子 分子 Daniel Le



ヘリウム 化学式 職場のあんぜんサイト 化学物質 ヘリウム




物質の構成 Fear121 ページ



なぜ原子番号が1つ違うだけで 水素とヘリウムのように全く違う性質になるのですか Quora



反応熱と熱化学方程式




ヘリウム原子 Wikipedia



理科ネタ 原子と元素のちがい 中学理科 ポイントまとめと整理



車山高原レア メモリーが語る 生命の起源origin Of Life



Q Tbn And9gcs7pj8ewfod1vvwpjgdo7coz3js3bkrqxd Baed3spehmgngfcg Usqp Cau



イオンの周期表 原子番号1番から番まで 3年理科 Takaの授業記録11




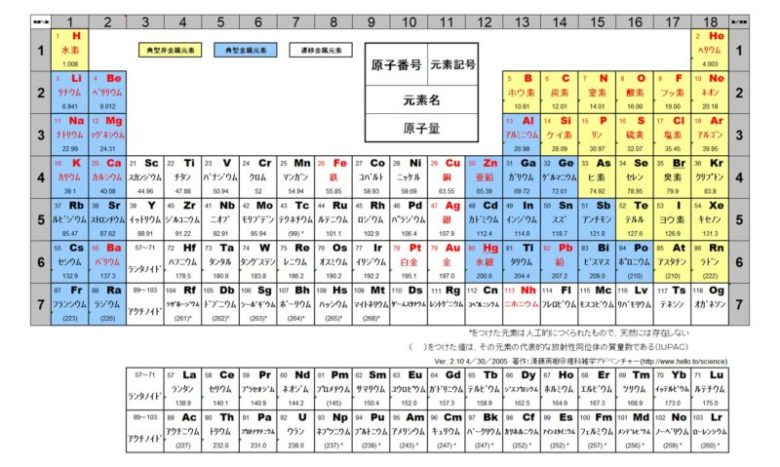
元素記号の覚え方は語呂合わせで解決 周期表や元素の性質も分かりやすく紹介 高校生向け受験応援メディア 受験のミカタ



化学式記号 Tourotom1 1




ヘリウム



新着記事一覧 とある化学教師でググって 楽天ブログ



水素水にこの世に存在しない物質の元素記号化学式が書かれる ゴゴ通信ゴゴ通信



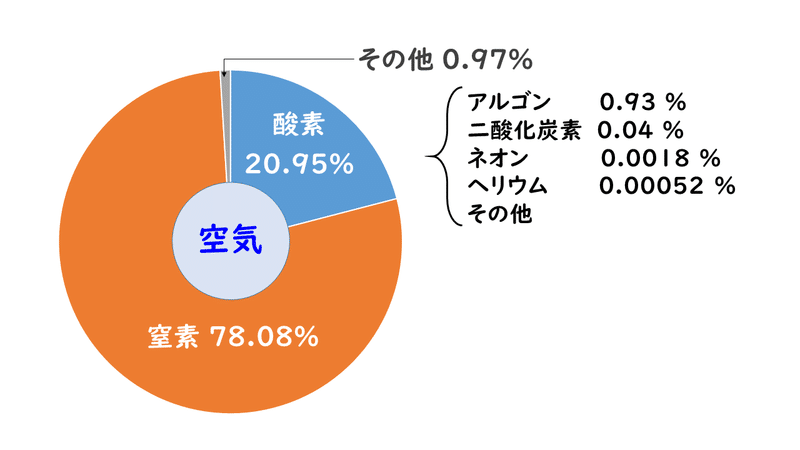
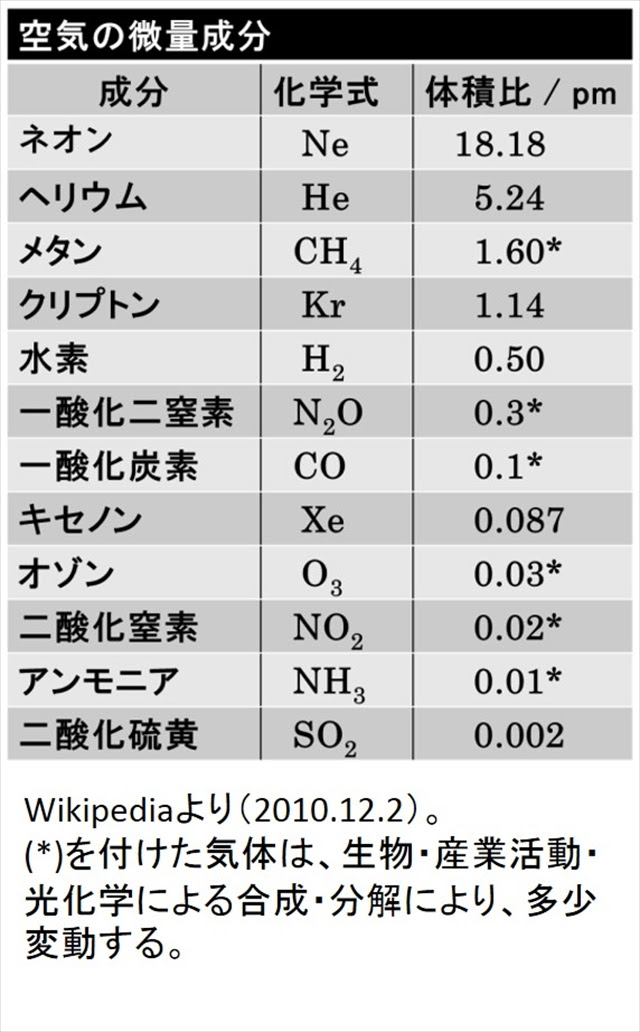
空気ってなに



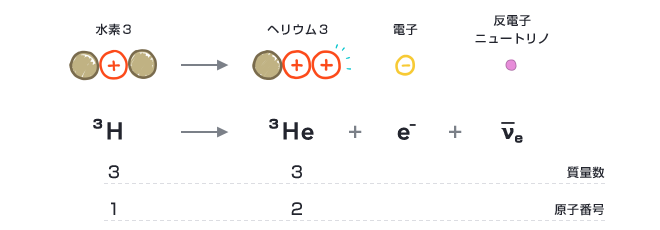
ヘリウム3 Wikipedia




トリチウム水から完全無害な水素ガスを作り出す Chem Station ケムステ



化学式のプリントを作って説明していたら 講師に言われたある一言 第二の家 ブログ 藤沢市の個別指導塾のお話




ヘリウム 化学式 職場のあんぜんサイト 化学物質 ヘリウム




He の元素記号としての意味はヘリウムですよね Clear




高1 化学基礎 まとめbook 1 高校生 化学のノート Clear



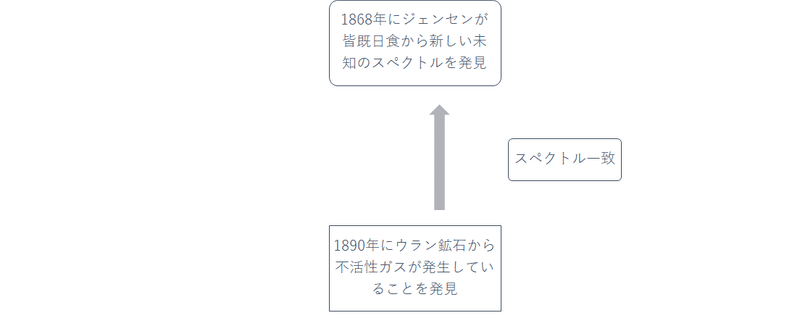
ヘリウムの発見




周期表 Wikipedia




高等学校化学i 物質と原子 Wikibooks




元素記号の覚え方は語呂合わせで解決 周期表や元素の性質も分かりやすく紹介 高校生向け受験応援メディア 受験のミカタ




理科 化学式 化学反応式 イオン式 中学生 理科のノート Clear




He 1 1 Descubre Como Resolverlo En Qanda
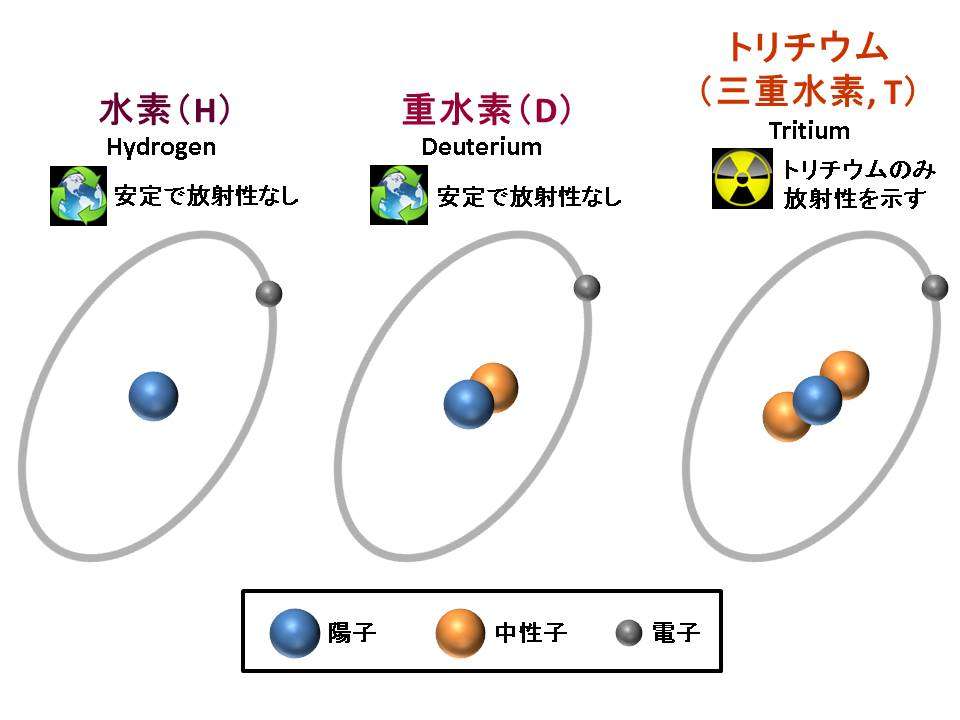



重水素ってなんだ 有用性と産業 科学的応用 第1話 水素と重水素 重い水素の正体 達人に訊け 中日新聞web



大学受験化学に役立つイオン化傾向の覚え方を1から解説します Studyplus スタディプラス




原子 記号 元素記号と原子記号は同じ意味と考えていいのでしょうか はい そうです 下




高校化学基礎 相対質量の計算 映像授業のtry It トライイット




Nha Lihat Cara Penyelesaian Di Qanda
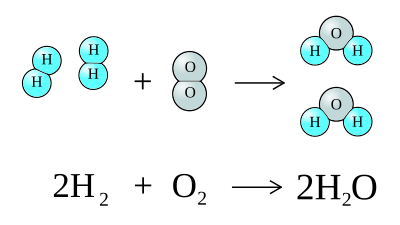



中学校理科 第1分野 化学変化と原子 分子 Wikibooks



Search Q E5 8c 96 E5 Ad A6 E5 8f Ab B4 Tbm Isch
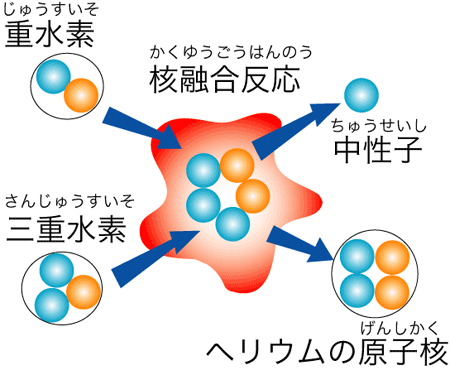



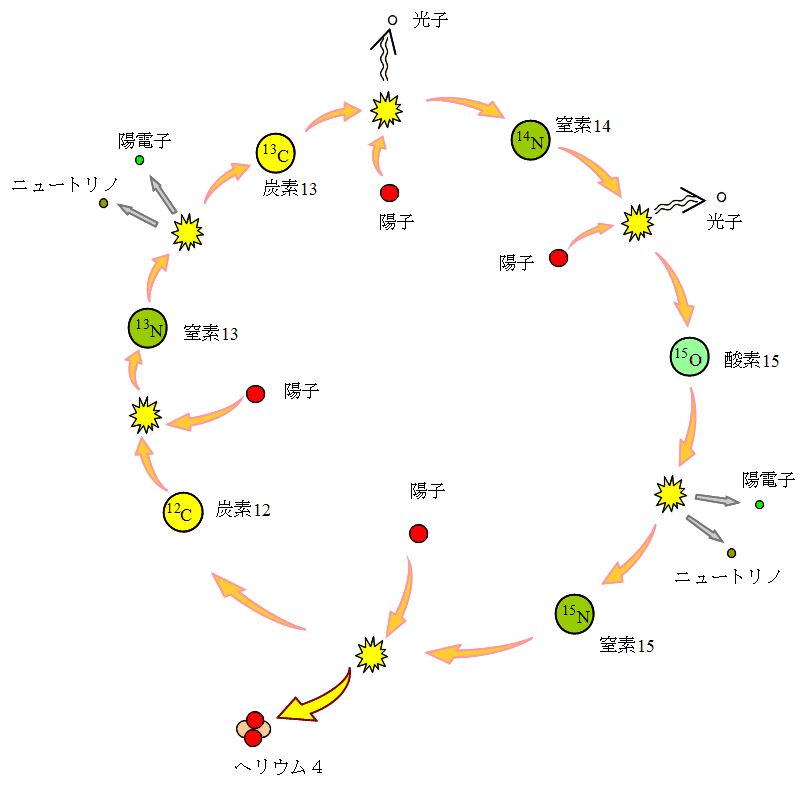
核融合へのとびら 自然科学研究機構 核融合科学研究所




物質の構成 Fear121 ページ




Woa1 層状複水酸化物含有複合材料及び電池 Google Patents
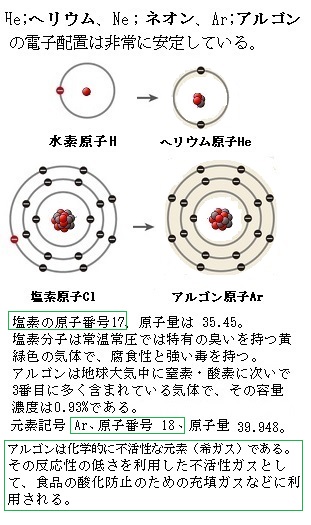



車山高原レア メモリーが語る 人の体の約15 を占める タンパク質の機構と生化学



1



第2章 どうやって放射線が出てくるのかについて考えよう 放射線について考えよう




元素記号の覚え方は語呂合わせで解決 周期表や元素の性質も分かりやすく紹介 高校生向け受験応援メディア 受験のミカタ




核融合エネルギーってなんだ



基礎化学




He の元素記号としての意味はヘリウムですよね Clear



太陽




水素化ヘリウムイオン 水素化ヘリウムイオンの概要 Weblio辞書




化学式を書く方法 百科事典 21



酸化還元反応 電子のやり取り



周期表についての質問です 水素とヘリウムの間 ベリリウムとホウ素の間 マ Yahoo 知恵袋



市民のためのがん治療の会



ヘリウム 化学式




Cna 1 4 3 6 双脱水己糖醇的混合二酯的组合物 Google Patents




He 1 1 Descubre Como Resolverlo En Qanda




Woa1 層状複水酸化物含有複合材料及び電池 Google Patents




元素記号 質量数 ヘリウム



Http Informatics Perkinelmer Co Jp Resource Manual Chemdrawv17userguide Pdf




ヘリウムの化学式 組成式 分子式 構造式 分子量は 電子配置は



ヘリウム 化学式 職場のあんぜんサイト 化学物質 ヘリウム



2




Amazon アトモン基本パック 遊びながら元素記号を学習できる化学バトル知育ゲーム 脳トレ 学習ゲーム おもちゃ
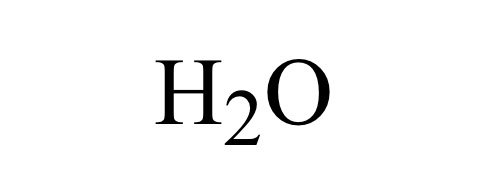



クイズで勉強 中2理科 化学式 個別指導塾 現役塾長の話 個別指導塾 現役塾長の話




ヘリウムの化学式 組成式 分子式 構造式 分子量は 電子配置は




ヘリウムってどんな物質 身近な例とともに化学系学生ライターがわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



Http Www Jikkyo Co Jp Contents Download



8 212 Descubre Como Resolverlo En Qanda




Amazon 幻冬舎 Gentosha ケミストリークエスト 新装版 カードゲーム トランプ おもちゃ



酸化還元反応 電子のやり取り



2 1 物質の分類 おのれー Note



Http Www Nara Wu Ac Jp Core Booklet Pdf Book19 Pdf



Heの元素記号としての意味はヘリウムですよね では 化学式としての意味は何 Yahoo 知恵袋



イオンの周期表 原子番号1番から番まで 3年理科 Takaの授業記録11



ヘリウムの電子式ってこれじゃなきゃいけないんですか 電子式ってとりあえず数が Yahoo 知恵袋




元素記号 質量数 ヘリウム



基礎化学



ヘリウムガスの特性として バックグラウンドが小さいとありますが Yahoo 知恵袋



2




中学校理科 第1分野 化学変化と原子 分子 Wikibooks




高1 化学基礎 まとめbook 1 高校生 化学のノート Clear



ヘリウムheとは Enab Note



ヘリウム 化学式 すべての鉱山クラフトのアイデア




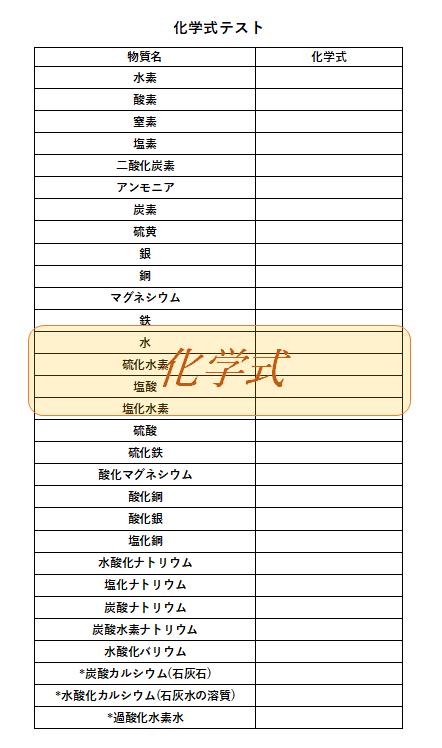
イオン式の一覧 中学生用




ヘリウム 化学式




イオンの生成をされるときに この矢印記号で表しているやつで 1 3 5のような問題は Clear




17 号 スピーカの振動板用フィルムの製造方法 Astamuse



0 件のコメント:
コメントを投稿